거친표면 인공유방 보형물로 인한 희귀암 발병이 확진된지 2개월 가까이 지났지만, 식품의약품안전처는 이식받은 환자조차 제대로 파악하지 못하고 있는 것으로 드러났다.
국회 보건복지위원회 정춘숙 의원(더불어민주당)은 7일 식품의약품안전처로부터 제출받은 자료를 확인한 결과, 안전성 정보 개별 통보가 이뤄진 환자는 9,832명으로, 이식받은 환자 6~7만명(추정치)의 15% 안팎에 불과하다고 지적했다.
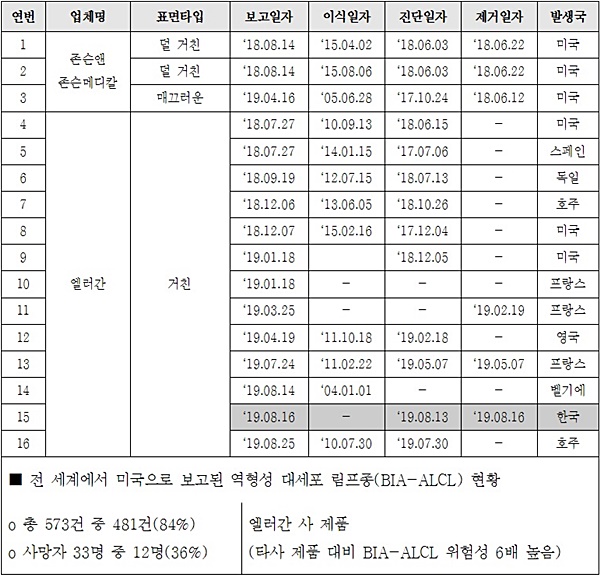
엘러간 사의 거친 표면 인공유방으로 인한 역형성 대세포 림프종(BIA-ALCL) 최종 확진이 된 날짜는 지난 8월 13일이다. 다음날 대한성형외과학회가 식약처에 보고를 했고, 식약처는 이를 이틀 후인 16일 확정발표하고 의료기관에 사용중지 명령을 내렸다. 안정성 정보를 환자에게 처음 통보한 것은 보름이 지난 8월 30일이다.
10월 4일 기준 엘러간 인공유방 보형물 8만 3,198개가 약 1,195개 의료기관을 통해 약 6~7만명의 환자에게 이식된 것으로 식약처는 추정했다. 이 중에 파악된 이식 환자는 837개 의료기관의 4만 4,478명이다. 하지만 안전성 정보에 관한 환자 개별 통보는 272개 의료기관 9,832명에 불과한 실정이다.
식약처가 환자를 파악하지 못하는 이유는 시스템 관리가 제대로 이뤄지지 않았기 때문이다.
의료기기 제조ㆍ수입ㆍ판매업체와 의료기관의 ‘의료기기 추적관리시스템’이 있지만 인공유방 보형물을 유통한 1,195곳 중에 시스템에 등록한 곳은 43.5%, 520곳에 불과하다. 나머지 675개 의료기관은 미등록 상태이다.
이 가운데 폐업한 의료기관은 412곳이나 된다. 특히 폐업한 412개 의료기관에서 이식한 환자는 파악이 사실상 불가능할 것으로 보인다.
또, 거친표면 인공유방 보형물의 위험성에 관한 식약처의 대응이 지나치게 늦었다는 점도 사태를 악화시키는데 한몫했다.
미국 FDA는 2011년부터 거친표면 인공유방 보형물과 관련한 환자등록 연구를 시작했으나, 식약처는 2011년부터 병원협회ㆍ의사협회 등을 통해 위험성, 의료인 및 환자 주의사항에 대한 안전성 서한을 배포만 했다.
이후 2019년 4월이 돼서야 이식환자 안전관리 강화를 위한 환자등록 연구를 추진해 지난 8월28일에서야 연구에 착수했다.
전 세계에서 미국으로 보고된 사례는 총 573건인데, 이 중 481건(84%), 사망 33명 중 12명(36%)이 엘러간 사 제품이다. 그만큼 엘러간 사 제품의 위험성이 높다는 의미다.
현재까지 식약처에 보고된 역형성 대세포 림프종(BIA-ALCL) 발생사례는 총 16건으로, 존슨앤존슨메디칼 사의 덜 거친 표면 2건 및 매끄러운 표면 1건, 엘러간 사의 거친표면이 13건(국내 1건 포함)이다.
정춘숙 의원은 식약처에 환자 안전을 위해 보다 적극적인 노력을 촉구하고 향후 계획과 대책 마련을 촉구했다.

