미국 FDA의 신약 승인 현황을 살펴본 결과, 지난해 미국에서 승인을 획득한 신약의 수가 최근 10년 사이 최저치를 기록한 것으로 나타났다.
제약산업 분석업체 ‘EvaluatePharma’가 최근 공개한 보고서에 따르면, 지난해 미국 FDA 승인을 획득한 신규조성물 신약(NMEs)과 생물의약품 신약(Biologicals)은 총 25개 품목인 것으로 확인됐다. 앞서, 미국 FDA는 지난 2015년 총 56개의 신약을 승인한 바 있다.
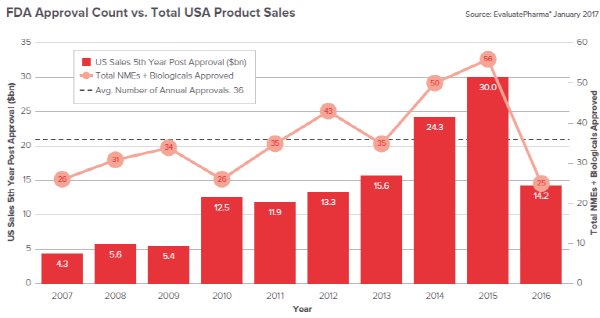
지난해 미국 FDA 승인 건수는 최근 10년(2007~2016년) 사이 평균 신약 승인건수인 36개에도 크게 미치지 못하는 것으로 나타났다.
최근 10년 미국 FDA 신약 승인건수(NMEs+Biologicals)는 ▲2007년 26건 ▲2008년 31건 ▲2009년 34건 ▲2010년 26건 ▲2011년 35건 ▲2012년 43건 ▲2013년 35건 ▲2014년 50건 ▲2015년 56건 ▲2016년 25건 등이다.
보고서는 지난해 신약 승인건수가 급감한 이유에 대해, FDA 규제 강화와 임상 단계에서의 R&D 실패, 신약 R&D 비용 증가 등의 요인이 복합적으로 작용한 것으로 해석했다.
지난해 미국 FDA 승인을 획득한 신약 중 블록버스터 기대주로는 ▲Tecentriq(atezolizumab) ▲Taltz(ixekizumab) ▲Zepatier(elbasvir+grazoprevir) ▲Epclusa(sofosbuvir+velpatasvir) ▲Ocaliva(obeticholic acid) 등이 지목됐다.
세부 내용을 살펴보면, 지난해 5월 방광암 치료제로 FDA 승인을 획득한 로슈의 면역항암제 ‘Tecentriq’는 오는 2022년 24억 달러의 연매출이 전망됐다.
또, 일라이릴리의 판상형 건선 치료제 ‘Taltz’와 MSD의 C형 간염 치료제 ‘Zepatier’는 오는 2022년 각각 14억 3,000만 달러와 13억 8,000만 달러의 매출을 올릴 전망이다.
기대주 4위는 길리어드의 C형 간염 치료제 ‘Epclusa’가 차지했으며, 5위는 인터셉트의 원발성 담즙성 담관염 치료제 ‘Ocaliva’가 이름을 올렸다. 이를 제품은 각각 13억 1,000만 달러와 12억 8,000만 달러의 매출이 전망됐다.
한편, 보고서는 올해 글로벌 시장 출시 및 향후 고매출이 전망되는 신약 기대주로 ▲Dupixent(사노피) ▲Ocrevus(로슈) ▲Durvalumab(아스트라제네카) ▲Semaglutide(노보노디스크) 등을 지목했다.

