올해 상반기 제네릭 의약품 개발 건수가 지난해 같은 기간 대비 약 30% 가량 줄어든 것으로 나타났다.
식품의약품안전처(처장 정승)는 2013년 상반기 제네릭의약품 개발을 위한 생물학적동등성시험계획 승인 현황을 분석한 결과, 승인건수는 총 79건으로 지난해 같은 기간 승인된 108건에 비해 27%정도 감소했다고 9일 밝혔다.
이러한 승인 감소세는 올해 특허가 만료되는 오리지널 의약품의 감소 및 공동 생동성시험 허용 등의 영향으로 분석된다.
최근 연도별 상반기 생동성시험계획 승인 건수를 보면, 2010년(176건), 2011년(114건), 2012년(108건), 2013년(79건)으로 지속적으로 감소하고 있다.
그 뒤로 소화성궤양치료제 ’구연산비스마스칼륨/라니티딘염산염/수크랄페이트‘ 및 정신분열 및 우울증치료제 ‘아리피프라졸’이 각각 5건(6.3%) 등의 순으로 많았다.
특히 올해 상반기 승인된 생동성 시험은 재심사 또는 특허 만료되는 의약품 개발 집중된 것으로 나타났다.
고지혈증치료제로 사용하는 ‘로수바스타틴칼슘’의 경우 특허가 2014년 4월에 만료 예정이고 고령화, 비만 및 서구화된 식습관으로 인해 개발이 가장 활발해 전체 승인건수의 12.7%(10건)로 조사됐다.
또한, 올해 11월에 재심사가 종료되는 치매치료제 ‘리바스티그민’도 승인건수가 6건으로 두 번째로 많았다.
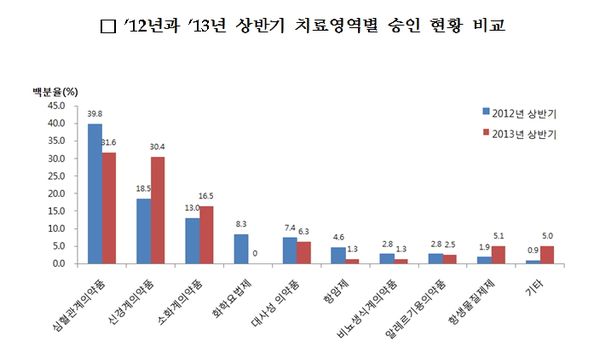
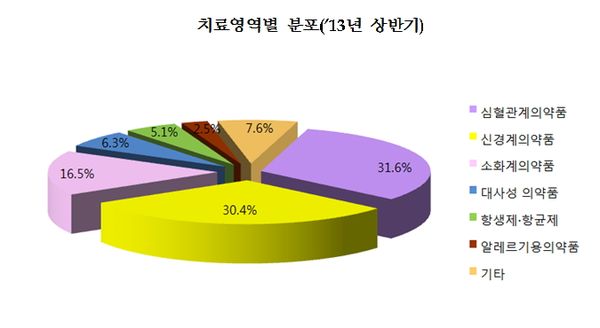
고지혈증 및 고혈압치료제 등 심혈관계의약품의 경우 올해 상반기 25건(31.6%)이 승인돼, 2012년 상반기(43건)에 비해 줄어들었다.
치매, 불안 및 우울장애, 과잉행동장애 치료제 등 신경계의약품의 경우, 고령화 사회 및 현대 사회 스트레스 증가에 따라 24건(30.4%)이 승인됐으며 2012년 상반기(20건)에 비해 개발이 증가하는 것으로 조사됐다.
위ㆍ십이지장궤양 치료제 등 소화계의약품은 스트레스 및 불규칙한 식습관 등으로 인한 소화기계 질환의 증가로 13건(16.5%) 승인됐으며, 2012년 상반기(14건)에 이어 꾸준히 개발되고 있다.
식약처는 최근 제네릭의약품의 개발은 고혈압, 고지혈증 등 만성질환 치료제를 중심으로 꾸준히 이루어지고 있으며, 특히 2013년 상반기에는 2012년에 비해 신경계의약품 개발이 지속적으로 증가하는 경향을 보였다고 설명했다.

