지난해 미국 FDA의 신약 승인 현황을 살펴본 결과, 전년대비 2배가 넘는 신약을 승인해 승인건수가 21년 만에 최고치를 기록한 것으로 나타났다.
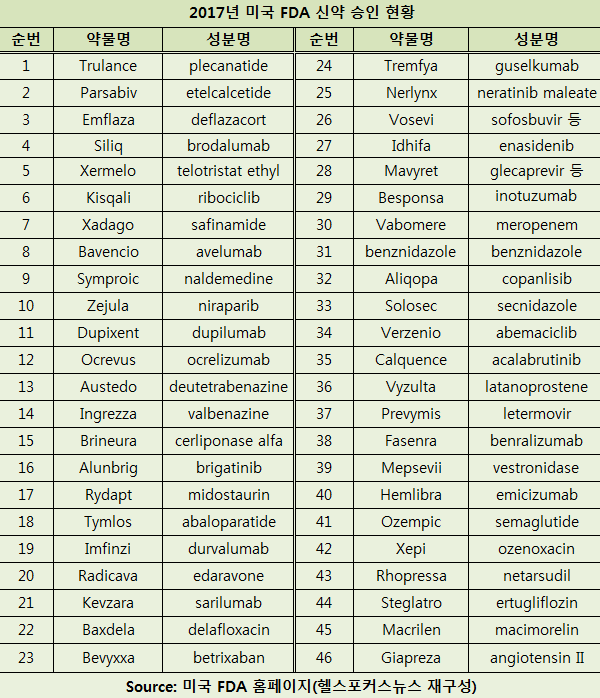
미국 FDA 홈페이지에 따르면, 지난해 승인을 획득한 신약은 총 46개 품목인 것으로 확인됐다. 이는 2016년 총 승인건수인 22건을 크게 상회하는 수치다.
FDA의 신약 승인 건수는 1996년 53건을 기점으로 감소 추세를 보여왔으며, 2011년 이후 재차 증가 추세를 보이고 있는 상황이다.
세부적으로는 ▲1996년 53개 ▲2005년∼2012년 18∼39개 ▲2013년 27개 ▲2014년 41개 ▲2015년 45개 ▲2016년 22개 ▲2017년 46개 등이다.
미국 FDA의 신약 승인건수 증가 원인은 신약개발 관련 기술의 발전과 신속승인 등 규제 효율화가 주요 요인으로 꼽히고 있다.
생명 현상과 질환에 대한 이해가 높아짐과 동시에 강력한 신약 발굴 툴과 기술 개발로 인해 신약개발 혁신이 이어지고 있으며, 특히 바이오의약품 개발 영역에 큰 영향을 미치고 있다는 분석이다.
이와 함께, 신속심사(Fast Track), 우선심사(Priority Review), 획기적 치료제(Breakthrough Designation), 가속승인(Accelerated Approval) 등 규제 효율화도 신약 심사시간을 단축시킴으로써 신약 승인건수 증가에 기여하고 있다는 평가다.
지난해 미국 FDA 관문을 넘은 주요 신약을 살펴보면, 시너지파마의 ‘트루란스(Trulance, plecanatide)’는 하루 한 번 경구 복용하는 만성 특발성 변비 치료제로 시판허가를 획득했다.
노바티스의 유방암 치료제 ‘키스콸리(Kisqali, ribociclib)’도 FDA 허가관문을 넘어 같은 계열의 약물인 화이자의 ‘입랜스’ 등과 경쟁하게 됐다.
면역항암제의 R&D 성과도 계속됐다. 독일 머크와 화이자가 공동 개발한 항 PD-L1 면역항암제 ‘바벤시오(Bavencio, avelumab)’를 희귀 피부암 치료제로 허가를 획득했으며, 아스트라제네의 임핀지(Imfinzi, durvalumab)는 진행성 방광암 치료제로 승인을 받았다.
지난해 로슈의 다발성경화증 치료 신약 ‘오크레부스(Ocrevus, ocrelizumab)’도 미국 허가관문을 넘었다. 오크레부스는 수초 및 신경돌기 손상에 관여하는 면역세포의 일종인 ‘CD20 양성 B세포’와 선택적으로 결합해 작용하는 항체약물이다.
이 약물은 ‘재발-이상성 다발성 경화증(Relapsing-Remitting Multiple Sclerosis), RRMS)’과 ‘원발성 진행성 다발성 경화증(Primary Progressive Multiple Sclerosis, PPMS)’ 치료 모두에 적응증을 보유하고 있다.
한편, 이번 FDA 신약 승인건수 자료에서 CAR-T 치료제 등 세포 및 유전자치료제는 별도의 항목으로 분류돼 집계에 포함되지 않았다.

