SK케미칼이 자체 개발한 바이오신약 ‘앱스틸라’(개발명 NBP601)가 올해 5월 국산 바이오신약 중 최초로 미 FDA 승인을 받았다. 또한 올해 11월 유럽 EMA 승인권고, 12월 캐나다 허가승인까지 이뤄냈다. 글로벌 시장조사기관인 데이터모니터는 최근 앱스틸라가 연 3,000억원에서 4,000억원의 매출액을 기록할 것이라고 추정하는 내용의 보고서를 발표했다.
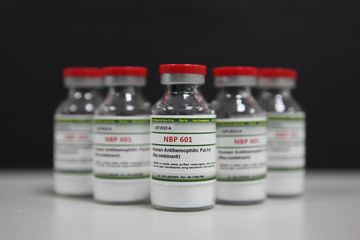
- 안녕, 넌 누구니?
나는 A형 혈우병 치료를 위해 세계 최초로 SK케미칼이 연구 개발한 ‘단일 사슬형 분자구조’를 가진 혈액응고 제8인자야.
- A형 혈우병과 혈액응고 제8인자가 무엇인지부터 알려줘.
혈우병은 유전성 돌연변이로 인해 혈액 내 응고인자가 부족해 발생하는 출혈성 질환으로, 전 세계 남성 1만명당 1명에게 발생하고 있어. 이때 혈우병은 부족한 응고인자에 따라 A형과 B형으로 나눠져.
혈액응고 제8인자는 혈액응고에 관여하는 13가지 인자 중 8번째 인자를 말해.
즉, 나는 A형 혈우병 중 80%에 달하는 혈액응고 제8인자의 결함 혹은 결핍으로 발생한 A형 혈우병에 사용되는 치료제지.
- 네 특징이 궁금해.
기존의 혈우병 치료제는 분리된 두 개의 단백질이 연합된 형태인 데 반해, 나는 두 단백질을 하나로 완전 결합시켜 안정성을 획기적으로 개선한 것이 특징이야.
이러한 유전자 결합구조의 변화로 나는 기존 제품보다 제8인자의 체내유지시간이 1.5~2배 가량 향상됐어. 결국 체내 반감기가 증가됐고 이에 따라, 주3~4회 투여해야 했던 기존 제품보다 적은 주1~2회로 투여횟수가 줄었지.
또 체내에 투여된 제8인자의 치료작용을 무력화시키는 면역반응도 없어. 혈우병 치료제는 질환의 특성상 환자가 평생 투여해야 하는 제품이기 때문에 면역원성을 보이지 않는 것이 매우 중요하다고.
- 체내 반감기가 늘고 면역원성이 없는 것은 다 임상을 통해 입증한 것일 텐데, 임상결과도 소개해줘.
성인 및 청소년 848명과 소아 347명을 대상으로 임상을 진행했어. 그 결과, 성인 및 청소년의 94%와 소아의 96%가 2회 이하 투여로 출혈이 효과적으로 조절됐어. 성인 및 청소년 81%와 소아 86%의 경우, 1회 투여로 출혈이 효과적으로 조절됐다고.
출혈에 대한 지혈 관리도 성인 및 청소년은 94%가, 소아는 96%가 매우 우수(excellent) 또는 우수(good)함을 보였어.
특히 A 형 혈우병의 인자를 대체하는 치료법에서 가장 심각한 부작용인 중화항체반응(약물의 효과를 저해하는 항체를 중화항체라고 하며 중화항체가 형성되는 반응)은 단 한 건도 보고되지 않아 안전성도 입증됐지.
- 올해 5월 미 FDA로부터 허가획득 후 9월부터 미국에서 판매되고 있고, 최근 캐나다 보건당국의 허가도 획득했다고 들었어. 앞으로의 계획이나 목표가 있다면?
미국에서의 입지를 넓히는 데 주력할 거야. 글로벌 시장조사기관인 데이터모니터에 따르면 미국의 A형 혈우병 치료제 시장은 2014년 기준 3조 6,000억원인데, 이는 전 세계 8조 4,000억원 중 가장 큰 규모야. 2023년에는 33% 증가한 4조 9,000억원에 달할 것으로 예상되고 있어. 이 시장에 성공적으로 안착하고 기존 제품을 빠른 속도로 스위칭하는 것이 우선돼야 할 것 같아.
캐나다에서도 판매허가 승인을 획득한 만큼 캐나다 내 혈우병 치료제 시장에 자리잡기 위한 노력도 당연히 해야 하고 말이야.
또 유럽과 호주에서도 승인될 것 같아. 현재 최종 시판 승인단계에 있거든. 유럽의 경우, EMA 산하 인체약품위원회로부터 시판허가 권고도 받았지. 뿐만 아니라, 국내 출시도 계획하고 있어.
- 그렇구나. 첫 번째 국산 바이오신약으로서 네 입지를 굳건히 하는 동시에, 블록버스터 의약품으로도 성장하길 바랄게.

