
유럽의약품청(European Medicines Agency, 이하 EMA)의 2015년도 신약 승인 현황을 살펴본 결과, 지난해 총 39개의 신약을 허가한 것으로 나타났다.
지난해 EMA의 첫 승인은 3월 19일(1개 품목) 이뤄졌으며, 마지막 승인은 12월 17일(3개 품목) 진행됐다.
2015년도 EMA의 첫 승인 품목은 메디슨(Medicines)이 개발한 항생제 ‘Orbactiv’로, 미국에서는 이미 2014년 8월 16일 승인을 획득한 바 있다.
지난해 EMA 허가를 획득한 신약의 타깃 질환을 살펴보면, 항암제가 13개로 가장 많았으며, 심혈관계 및 대사질환 치료제(7개), 항감염제(5개), 항응고제(5개) 등이 뒤를 이었다.
EMA가 지난해 시판을 허가한 39개의 신약 중 미국(FDA)보다 승인이 앞선 품목은 6개에 불과한 것으로 나타났다.
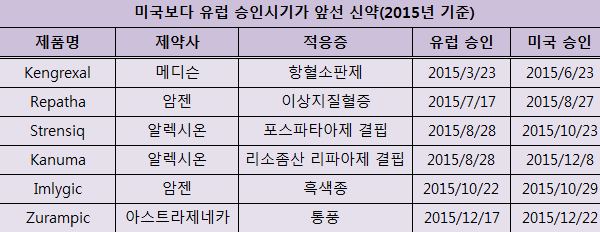
미국보다 유럽 승인시기가 앞선 6개 신약은 ▲Kengrexal(메디슨) ▲Repatha(암젠) ▲Strensiq(알렉시온) ▲Kanuma(알렉시온) ▲Imlygic(암젠) ▲Zurampic(아스트라제네카) 등이다.
지난해 EMA 허가를 획득한 신약 중 3개 품목(Episalvanㆍ Briviactㆍ Wakix)은 아직 미국에서는 승인을 획득하지 못한 것으로 나타났다.
신속검토(accelerated assessments)를 통해 승인을 획득한 신약은 총 5개 품목으로, 이들 제품은 검토기간이 210일에서 150일로 단축됐다.
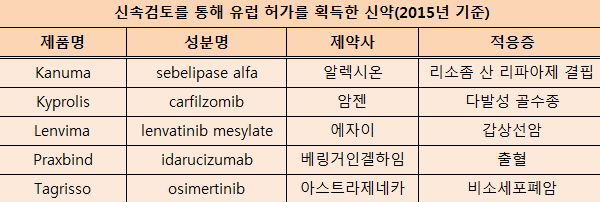
신속검토를 통해 유럽 허가를 획득한 신약은 ▲Kanuma(알렉시온) ▲Kyprolis(암젠) ▲ Lenvima(에자이) ▲Praxbind(베링거인겔항임) ▲Tagrisso(아스트라제네카) 등이다.
EMA가 지난해 시판을 허가한 39개의 신약 중 희귀의약품(orphan drug)은 총 18개 품목인 것으로 나타났다. 주요 제품은 ▲Blincyto(암젠) ▲Farydak(노바티스) ▲Kanuma(알렉시온) ▲Lenvima(에자이) 등이다.
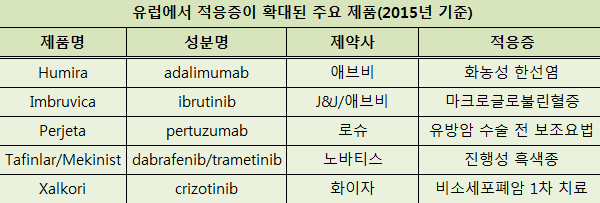
지난해 EMA는 총 57개 품목의 적응증 확대를 승인했다. 적응증이 확대된 주요 제품에는 ▲휴미라(애브비) ▲임브루비카(존슨앤드존슨/애브비) ▲퍼제타(로슈) ▲타핀라/메키니스트(노바티스) ▲잴코리(화이자) 등이 있다.
한편, EMA와 함께 글로벌 양대 신약 승인당국인 미국 FDA는 지난해 총 45개의 신약을 허가했다. 이 가운데 희귀의약품 지정(Orphan Drug Designation)을 받은 신약은 14개 제품이다.

