식품의약품안전처(처장 김강립)는 길리어드사(社) 코로나19 치료제 ‘베클루리주(렘데시비르)’의 투약범위에 ‘중증으로 진행될 위험이 높은 경증에서 중등증의 성인과 소아(12세 이상 이고, 40kg 이상) 환자’를 추가해 20일 긴급사용승인했다.
앞서 질병관리청은 1월 8일 ‘베클루리주(렘데시비르)’ 해당 내용의 긴급사용승인을 요청했다.
이번 긴급사용승인은 ‘베클루리주(렘데시비르)’의 경증에서 중등증 환자 임상시험 결과와 유럽의 허가 사례 등을 종합적으로 검토해 전문가 자문과 위원회 심의를 거쳐 결정한 것이다.
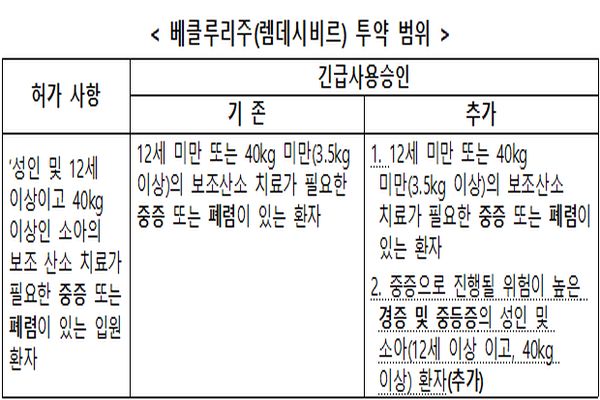
이에 따라 경증에서 중등증 환자에게도 ‘베클루리주(렘데시비르)’를 사용할 수 있게 됐다.
식약처는 지난 1월 7일 ‘베클루리주(렘데시비르)’의 투약 범위를 ‘성인과 12세 이상이고 40kg 이상인 소아의 보조산소 치료가 필요한 중증 또는 폐렴이 있는 입원 환자’로 변경 허가했다.
당시 허가 사항 변경으로 국내에서 ‘12세 미만 또는 40kg 미만’ 소아 환자에게 사용 가능한 코로나19 치료제가 없게 된 상황을 고려해 긴급사용승인 조치를 지난 1월 7일 함께 발표했다.
식약처는 ‘베클루리주(렘데시비르)’의 소아 대상 국ㆍ내외 사용례와 미국ㆍ일본 등 해외 승인 사례 등을 검토해 ‘12세 미만 또는 40kg 미만(3.5kg 이상)의 소아 환자’에 대해서는 긴급사용승인의 형태로 사용할 수 있도록 했다.
식약처 관계자는 “앞으로도 의료제품에 대해 규제과학 전문성을 바탕으로 허가심사ㆍ긴급사용승인할 것이며, 코로나19 극복과 국민의 일상 회복을 위해 안전하고 효과 있는 제품을 신속히 공급할 수 있도록 최선을 다하겠다.”라고 말했다.

